Анализ на вирус Эпштейна-Барр является важным элементом диагностики, особенно учитываю большую распространенность такой инфекции по всему миру. Статистика утверждает, что до 90% всего населения Земли в той или иной форме подвергались воздействию этого возбудителя, а большая часть людей после общения с этим вирусом становится пожизненным его носителем и источником инфекции.
Вирус Эпштейна-Барр у взрослых
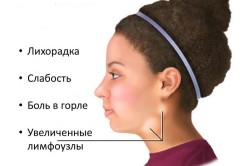
У большинства маленьких детей болезнь протекает бессимптомно, с типичными симптомами у подростков и взрослых. В начале болезни лихорадка выше 38 градусов Цельсия, лимфатические узлы шеи увеличены, опухание и толще, боль в горле и тонзиллит - желто-зеленые лучи. Кожная сыпь может появляться на всем теле. Затем увеличена печень и селезенка.
Подозрение инфекционного мононуклеоза основано на симптомах и результатах медицинского обследования. Для подтверждения заболевания проводятся лабораторные испытания. Если ручные мазки крови выполняются, количество лейкоцитов увеличивается, и появляются лимфоциты. Качественный метод определит, присутствует ли вирус в крови или нет, но по количественному методу можно оценить точное количество вирусных частиц, присутствующих в данном объеме крови.
- Морфология крови, которая увеличивает количество лейкоцитов.
- Их присутствие свидетельствует о свежей инфекции.
Такая распространенность инфекции иногда вводит человека в заблуждение, и он считает ненужным анализ на вирус Эпштейна-Барр. Однако такое утверждение неверно. Эти анализы просто необходимы при планировании беременности, чтобы защитить будущего ребенка, они нужны всем, у кого есть подозрение на заражение, для выявления ряда инфекционных поражений и предотвращения нежелательных последствий для здоровья.
Более того, если даны некоторые антибиотики, сыпь может ухудшиться! Применяются симптомы, облегчение боли и лихорадка, такие как парацетамол или ибупрофен. Детям с инфекционным мононуклеозом должна быть предоставлена возможность отдыха. Из-за того, что боль в горле может предотвратить глотание твердых продуктов, очень важно, чтобы ваш ребенок избежал обезвоживания.
Как только симптомы разрешатся, ребенок может вернуться в школу, но на какое-то время отказаться от спортивных занятий, таких как волейбол или баскетбол. У некоторых младенцев с инфекционным мононуклеозом селезенка увеличивается поздно, один из внутренних органов в верхней части живота, слева. Увеличенная селезенка очень чувствительна к повреждению и даже относительно небольшое воздействие на живот может привести к тому, что ребенок истечет кровью в органе. Если отмечено увеличение селезенки, спорт следует остановить до тех пор, пока размер селезенки не станет нормальным.
Сущность инфекции
 Вирус Эпштейна-Барр (ВЭБ) представляет собой разновидность герпесвируса, а именно вирус герпеса человека IV типа. При заражении возбудитель попадает в эпителий ротоглотки и слюнной железы, провоцируя активную инфекцию, что выражается в наличии вируса в слюне. Далее он распространяется на эпителий носоглотки и поражает В-лимфоциты, не затрагивая Т-лимфоциты крови. При воздействии вируса лимфоциты способны видоизмениться с появлением клонов в виде атипичных лимфоцитов. Попадая в организм, ВЭБ провоцирует ответ иммунной системы как гуморального, так и клеточного типа.
Вирус Эпштейна-Барр (ВЭБ) представляет собой разновидность герпесвируса, а именно вирус герпеса человека IV типа. При заражении возбудитель попадает в эпителий ротоглотки и слюнной железы, провоцируя активную инфекцию, что выражается в наличии вируса в слюне. Далее он распространяется на эпителий носоглотки и поражает В-лимфоциты, не затрагивая Т-лимфоциты крови. При воздействии вируса лимфоциты способны видоизмениться с появлением клонов в виде атипичных лимфоцитов. Попадая в организм, ВЭБ провоцирует ответ иммунной системы как гуморального, так и клеточного типа.
Косвенные анализы на вирус Эпштейн-Барра
Из-за того, что вирус Эпштейна-Барра передается слюной, важно объяснить больному ребенку, чтобы он не делился своей пищей или напитком со здоровыми людьми. По словам ученых, он встречается более чем на 80%. Население и чаще всего спят, и одноразовая инфекция иммунизируется на всю жизнь. Вирус состоит из нуклеиновой кислоты и спирали. В зависимости от антитела, продуцируемого организмом, можно определить, когда он вступил в контакт с вирусом - была ли инфекция свежей, была в течение некоторого времени или произошла в прошлом.
Вирус обладает четырьмя основными антигенами: ранний (появляется в ядре и цитоплазме), капсидный (присутствует в нуклеокапсиде), мембранный и ядерный (содержит полипептиды) типы. Выявлено 2 характерных штамма – А и В. В период длительного существования ВЭБ может находиться в хронической (наибольшее распространение), медленно развивающейся и латентной форме; хроническая форма периодически рецидивирует острой фазой.
Риск заражения уже проявляется у очень маленьких детей, когда количество антител, полученных от матери, значительно уменьшается, что защищает от инфекции и инфекции. Так называемая первичная инфекция обычно бессимптомная или очень мягкая. Реинфекция происходит при контакте с больным. С развитием инфекции, лейкоцитов и распространением крови по всему телу.
Вирус Эпштейна-Барра состоит из сферических вихрей. Если анализ крови подтверждает наличие этих двух типов иммуноглобулина, инфекция свежая или была вокруг в течение некоторого времени. Тест на наличие вируса у людей, у которых есть симптомы, указывающие на мононуклеоз, и тест на подтверждение заболевания отрицательный.
- синдром хронической усталости;
- мононуклеозы (в т.ч. аденоз, железистая лихорадка, болезнь Филатова);
- болезнь Ходжкина;
- лимфома Беркитта;
- карцинома носоглотки;
- синдром Стивенса-Джонсона;
- гепатит;
- герпес;
- герпангина;
- рассеянный склероз;
- лейкоплакия;
- болезнь Кикути.
Наиболее часто проявление в виде острой формы инфекционного мононуклеоза.
Хотя сама инфекция не опасна, пациенты с мононуклеозом могут вызывать опасные осложнения. Одна из них может быть кашляющей селезенкой, которая в некоторых случаях является одним из признаков рака. Инфекционный мононуклеоз, также называемый конъюнктивит, вызван пролиферацией активного вируса в хрящах клеток и лейкоцитов. Инфекционная инфекция приводит к распаду инфицированных клеток и высвобождению вируса, который начинает распространяться по всему организму, вызывая воспаление.
Причины - вирус Эпштейна-Барра
Это один из так называемых вирусов. герпес. В общем, заражение вирусом приводит к стабильному иммунитету, а неактивная форма вируса остается в клетках на протяжении всей жизни человека. В результате снижения уровня антител при рождении риск инфицирования вирусом Эпштейна-Барра увеличивается. Что вызывает эту инфекцию? В большинстве случаев инфекция не приводит к каким-либо симптомам или неотличима от других доброкачественных, краткосрочных детских заболеваний.
Принцип проведения анализа
Определение содержания ВЭБ обычно проводится на основе (ИФА). Принцип такого исследования основан на том, что на любой антиген патогенного возбудителя иммунная система вырабатывает иммуноглобулин (антитело) для блокирования и нейтрализации чужеродной клетки. При первом знакомстве с инфекцией вырабатывается антитело группы М (lgM), а для противодействия укоренившемуся вирусу – антитела класса G (lgG).
Прямой причиной инфекции является прямой контакт с слюнными железами больного, поэтому часто это заболевание называют «поцелуем». Инфекционный мононуклеоз вызван вирусом Эпштейна-Барра, который атакует главным образом горло и ухо. Среди наиболее характерных симптомов - общая слабость, головная боль и горло. Во время ослабления иммунной системы вирус может стать активным.
Может ли вирус Эпштейна-Барр вызывать хроническую инфекцию?
Мы часто не осознаем прошлый мононуклеоз, потому что он проявляет мягкую боль в миндалинах или горле. Инфекция обычно начинается внезапно. Иногда, однако, появляются начальные симптомы: отсутствие аппетита, недомогание, боли в мышцах и суставах. Примерно у 50% пациентов развивается увеличение селезенки, и около трети пациентов испытывают увеличение печени. Могут появиться другие симптомы, такие как тошнота, расстройство желудка, боль в животе. Мононуклеоз может стать хроническим заболеванием, так называемым.
Анализ крови или слюны способен выявить иммуноглобулины обоих типов, а по их уровню провести оценку наличия в организме инфекции. Расшифровка анализа базируется на том, что положительным результатом признается высокий уровень их содержания (в организме есть инфекция), а отрицательный результат – существенно пониженное их количество, что указывает на отсутствие необходимости выработки антител.
Синдром хронической усталости сопровождается снижением активности, постоянной усталостью и слабостью, а также проблемами концентрации. Характерным симптоматическим синдромом, который особенно связан с инфекцией вируса Эпштейна-Барра, является: - Очень высокая температура, которая характеризуется очень долговременной - Значительное увеличение лимфатических узлов. Их характерной особенностью является повышенная нежность, которая может даже входить в болезненность - увеличенная печень и селезенка в результате роста лимфоидной ткани.
Он обычно появляется в конце первой недели болезни. - Многочисленные инфекции горла и миндалины, сопровождающиеся сильной болью и трудностями при глотании. Вирус Эпштейна-Барра отвечает за развитие инфекционного заболевания так называемого мононуклеоза. То, что характерно для такого рода заболеваний, передается капелькой.
Антитела на вирус Эпштейна-Барр
 С учетом наличия 4 антигенов ВЭБ следует ожидать образования соответствующих антител, их содержание характерно для разного поражения этим возбудителем. Иммуноглобулин lgM к антигену капсидного типа (VCA) вырабатывается активно при острой фазе ВЭБ-инфекции. Его содержание быстро растет в начальный период инфицирования и практически исчезает после 30-40 дней болезни, но проявляется вновь при рецидивах. Антитела lgG приходят на смену lgM и могут остаться на всю жизнь, даже после полного выздоровления, а при очередном обострении или повторном инфицировании их количество растет.
С учетом наличия 4 антигенов ВЭБ следует ожидать образования соответствующих антител, их содержание характерно для разного поражения этим возбудителем. Иммуноглобулин lgM к антигену капсидного типа (VCA) вырабатывается активно при острой фазе ВЭБ-инфекции. Его содержание быстро растет в начальный период инфицирования и практически исчезает после 30-40 дней болезни, но проявляется вновь при рецидивах. Антитела lgG приходят на смену lgM и могут остаться на всю жизнь, даже после полного выздоровления, а при очередном обострении или повторном инфицировании их количество растет.
Нет конкретных лекарств или вакцин против мононуклеоза, но это не означает, что организму приходится иметь дело с ним в одиночку. Специалисты-врачи рекомендуют особенно осторожно, а в случае лихорадки не оставляйте постель. В некоторых случаях рекомендуется принимать препараты, содержащие парацетамол или ибупрофен, чтобы помочь в лечении боли в мышцах и голове.
Очень важным фактором в лечении является правильное количество жидкости и постоянное пополнение их, чтобы не привести к обезвоживанию. Также рекомендуется диета, легкая для облегчения печени и не раздражающая боль в горле. Мононуклеоз очень утомительно для всего организма, поэтому пациент не должен покидать дом и перенапрягаться, рекомендуется не заставлять тело.
К другим антигенам вырабатываются в основном антитела типа lgG. Иммуноглобулины к антигену раннего типа (ЕА) вырабатываются на начальной стадии острой фазы. Они проявляются уже через несколько дней после заражения, а исчезают через 4-6 месяцев.
Антитела lgG к антигену ядерного типа (ЕBNA) достигают определимого уровня через 4-5 месяцев после инфицирования, даже если заболевание протекает бессимптомно.
Продромы с астенией, общее недомогание и миалгия могут длиться 1-2 недели до начала лихорадки, фарингита и лимфаденопатии. Лихорадка обычно умеренная и наиболее распространена в первые 2 недели заболевания; Однако это может продолжаться более месяца. Частые признаки и симптомы представлены вместе с частотой их появления в 186-м. Лимфаденопатия и фарингит распространены в течение первых 2 недель заболевания, а спленомегалия чаще встречается в течение второй и третьей недель. Лимфаденопатия чаще всего поражает шейные задние ганглии, но может быть обобщена.
В основном они сохраняются в организме очень длительный срок, поэтому могут выявляться почти у 90% взрослых людей. При активизации болезни наблюдается рост уровня lgG EBNA. Их повышенный фон может указывать на хроническую форму развития заболевания.
Проведение анализов на основе ИФА
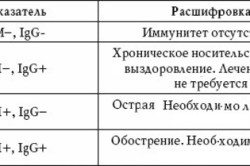
 Определение наличия антител проводится на пробах венозной крови и слюны. При отсутствии инфекции антитела не выявляются. В острой форме заболевания обнаруживается lgM VCA; могут присутствовать lgG VCA и lgG EA; lgG EBNA отсутствует. При острой фазе хронической формы болезни могут присутствовать lgM VCA и lgG VCA; обязательно обнаруживаются lgG EA и lgG EBNA. В атипичном течении хронической формы lgM VCA отсутствует, возможно наличие lgG VCA, содержатся lgG EA и lgG EBNA.
Определение наличия антител проводится на пробах венозной крови и слюны. При отсутствии инфекции антитела не выявляются. В острой форме заболевания обнаруживается lgM VCA; могут присутствовать lgG VCA и lgG EA; lgG EBNA отсутствует. При острой фазе хронической формы болезни могут присутствовать lgM VCA и lgG VCA; обязательно обнаруживаются lgG EA и lgG EBNA. В атипичном течении хронической формы lgM VCA отсутствует, возможно наличие lgG VCA, содержатся lgG EA и lgG EBNA.
Большие лимфатические узлы часто чувствительны и симметричны, но они не являются приверженцами. Фарингит, часто преобладающий признак, может сопровождаться гипергидрозом миндалины с экссудатом, сходным с экссудатом стрептококкового фарингита. Приблизительно 5% случаев проявляют болезнетворную или папулезную сыпь, часто в руках и туловище. Большинство пациентов, получавших ампициллин, имеют малые пятна; Эта сыпь не является прогнозом будущих побочных реакций на пенициллин. Также описана узловатая эритема и многообразная эритема.
Большинство пациентов имеют симптомы в течение 2-4 недель, но общее недомогание и трудности с концентрацией могут сохраняться в течение нескольких месяцев. В целом, лимфоцитоз подтверждается более чем 10% атипичными лимфоцитами. Последние представляют собой крупные лимфоциты, которые имеют обильную цитоплазму, вакуоли и клеточные мембраны с углублением. Умеренная нейтропения и тромбоцитопения распространены в течение первого месяца болезни. Печеночная функция изменяется более чем в 90% случаев. Уровень аминотрансферазы и щелочной фосфатазы в сыворотке обычно незначительно увеличивается; Концентрация билирубина в сыворотке увеличивается примерно в 40% случаев.
В случаях когда возбудитель находится в латентном состоянии, lgM VCA и lgG VCA отсутствуют, а отмечаются lgG EA и lgG EBNA. В состоянии выздоровления после медикаментозного лечения присутствует только lgG EBNA. В фазе реактивации при хронической форме болезни обнаруживаются все виды иммуноглобулинов. При наличии злокачественных образований, причиной которых становится ВЭБ, анализ крови дает следующий результат: отсутствие lgM VCA и малая вероятность наличия lgG EBNA, но значительно завышенный уровень lgG VCA и lgG EA.
Гипертрофия лимфоидной ткани в миндалинах или аденоидной растительности может привести к обструкции верхних дыхательных путей, что также может быть результатом воспаления и отека в надгортаннике, глотке или небе. Приблизительно у 10% пациентов с инфекционным мононуклеозом развивается стрептококковый фарингит после первичного фарингита.
Анатомопатологические исследования показывают гиперплазию В-клеток или поли - или моноклональную лимфому. Инфекционный мононуклеоз также был фатальным у некоторых пациентов без ранее существовавших иммунных нарушений. Поэтому может потребоваться повторить тест, особенно если начальный тест проводится на ранней стадии. Как правило, тесты остаются положительными в течение 3 месяцев после начала заболевания, но гетерофильные антитела могут сохраняться более 1 года. Эти антитела обычно не обнаруживаются у детей в возрасте до 5 лет у пожилых людей или у пациентов, у которых нет типичных симптомов инфекционного мононуклеоза.
Расшифровка результатов
 Положительный результат, т.е. наличие инфекции, может быть вызван следующими причинами: острая форма мононуклеоза; активная фаза хронической формы инфекции; опухолевые образования; прошедшая инфекция в течение до полугода после выздоровления. Ложноположительный результат может быть получен при нарушении подготовительного периода или неправильном взятии пробы. На результат анализа могут повлиять гемолиз взятой пробы, повышенная концентрация липидов, бактериальное загрязнение посуды, в которой находится проба. Ложноположительная оценка может возникнуть при следующих заболеваниях: токсоплазмоз, цитомегаловирусное заражение, герпесы другого типа, иммунодефицит.
Положительный результат, т.е. наличие инфекции, может быть вызван следующими причинами: острая форма мононуклеоза; активная фаза хронической формы инфекции; опухолевые образования; прошедшая инфекция в течение до полугода после выздоровления. Ложноположительный результат может быть получен при нарушении подготовительного периода или неправильном взятии пробы. На результат анализа могут повлиять гемолиз взятой пробы, повышенная концентрация липидов, бактериальное загрязнение посуды, в которой находится проба. Ложноположительная оценка может возникнуть при следующих заболеваниях: токсоплазмоз, цитомегаловирусное заражение, герпесы другого типа, иммунодефицит.
Показания к проведению анализа
Коммерчески доступный тест на моноспот для гетерофильных антител несколько более чувствителен, чем классический тест на гетерофил. Ложноположительные результаты в исследовании моноспота чаще встречаются у детей и пациентов с другими вирусными инфекциями. Серологические тесты полезны у маленьких детей, которые часто не развивают гетерофильные антитела. Антитела против ранних антигенов либо находятся в форме диффузного рисунка в ядре и цитоплазме инфицированных клеток, либо ограничены в цитоплазме.
Отрицательный результат, т.е. отсутствие всех маркеров, может быть зафиксирован в следующих случаях: отсутствие ВЭБ; незавершенный инкубационный период инфицирования; окончание болезни (по прошествии 6 месяцев после реального окончания болезни); латентное состояние возбудителей (человек является только переносчиком вируса). При возникновении сомнений по результатам анализа исследование необходимо повторить через 12-14 дней.
Анализ с применением метода ПЦР
Использование анализа на ВЭБ с применением метода ИФА часто не может дать точного диагноза, что требует дополнительных уточняющих исследований. Высокую точность диагностики дает анализ, основанный на методе полимерной цепной реакции (ПЦР) с обнаружением вирусной ДНК. На исследование берется проба крови, мочи, мокроты, слюны, околоплодных вод у беременных женщин.
Чаще всего исследования проводятся на венозной крови. Метод ПЦР является дополнением к анализам с применением ИФА в случаях, когда этот анализ не дает однозначной трактовки результатов. Эффективно применение ПЦР при анализе крови только при острых формах болезни и фазах обострения. При хронических формах и для оценки правильности лечения этот анализ крови не используется. Особо рекомендуется применение подобных исследований для новорожденных. Большей информативностью по определению ДНК вируса в хронических и атипичных формах имеет анализ проб слюны.
Помимо проб крови и слюны вирус Эпштейн-Барра может выявляться дополнительно по выпотеванию, соскобу клеток эпителия носовой слизистой оболочки, соскобу эпителия ротоглотки, спинномозговой жидкости, эякуляту, соскобу эпителиальных клеток урогенитального канала.
Какие заболевания могут вызвать вирус Эпштейна-Барра? Какие симптомы типичны для ВЭБ-инфекции?
Существуют ли строго специфичные для ВЭБ изменения лабораторных показателей?
Что включает в себя комплексная терапия ВЭБ-инфекции?
В последние годы наблюдается рост числа больных, страдающих хроническими рецидивирующими инфекциями, которые во многих случаях сопровождаются выраженным нарушением общего самочувствия и целым рядом терапевтических жалоб. Наиболее широко распространены в клинической практике (чаще вызывается Herpes Simplex I), (Herpes zoster) и (чаще вызывается Herpes simplex II); в трансплантологии и гинекологии часто встречаются заболевания и синдромы, вызванные цитомегаловирусом (Cytomegalovirus). Однако о хронической инфекции, вызванной вирусом Эпштейна-Барр (ВЭБ), и ее формах врачи общей практики осведомлены явно недостаточно.
ВЭБ был впервые выделен из клеток лимфомы Беркетта 35 лет назад. Вскоре стало известно, что вирус может вызывать у человека острый и . В настоящее время установлено, что ВЭБ ассоциирован с целым рядом онкологических, преимущественно лимфопролиферативных и аутоиммунных заболеваний (классические , и др.). Кроме того, ВЭБ может вызывать хронические манифестные и стертые формы заболевания, протекающие по типу хронического мононуклеоза . Вирус Эпштейна—Барр относится к семейству герпес-вирусов, подсемейство гамма-герпес-вирусов и род лимфокриптовирусов, содержит две молекулы ДНК и обладает способностью, как и другие вирусы этой группы, пожизненно персистировать в организме человека . У части больных на фоне иммунной дисфункции и наследственной предрасположенности к той или иной патологии ВЭБ может вызывать различные заболевания, о которых упоминалось выше. ВЭБ инфицирует человека, проникая через интактные эпителиальные слои путем трансцитоза в нижележащую лимфоидную ткань миндалин, в частности В-лимфоциты . Проникновение ВЭБ в В-лимфоциты осуществляется через рецептор этих клеток CD21 — рецептор к С3d-компоненту комплемента. После инфицирования число пораженных клеток увеличивается посредством вирус-зависимой клеточной пролиферации. Инфицированные В-лимфоциты могут значительное время находиться в тонзиллярных криптах, что позволяет вирусу выделяться во внешнюю среду со слюной.
С инфицированными клетками ВЭБ распространяется по другим лимфоидным тканям и периферической крови. Созревание В-лимфоцитов в плазматические клетки (что происходит в норме при их встрече с соответствующим антигеном, инфектом) стимулирует размножение вируса, а последующая гибель (апоптоз) этих клеток приводит к выделению вирусных частиц в крипты и слюну. В инфицированных вирусом клетках возможно два вида размножения: литический, то есть приводящий к гибели, лизису, клетки-хозяина, и латентный, когда число вирусных копий небольшое и клетка не разрушается. ВЭБ может длительно находиться в В-лимфоцитах и эпителиоцитах назофарингеальной области и слюнных желез. Кроме того, он способен инфицировать другие клетки: Т-лимфоциты, NK-клетки, макрофаги, нейтрофилы, эпителиоциты сосудов . В ядре клетки-хозяина ДНК ВЭБ может формировать кольцевую структуру — эписому, либо встраиваться в геном, вызывая хромосомные нарушения .
При острой или активной инфекции преобладает литическая репликация вируса.
Активное размножение вируса может происходить в результате ослабления иммунологического контроля, а также стимуляции размножения клеток, инфицированных вирусом под действием целого ряда причин: острой бактериальной или вирусной инфекции, вакцинации, стрессов и др.
По данным большинства исследователей, сегодня примерно 80—90% населения инфицировано ВЭБ. Первичная инфекция чаще возникает в детском или молодом возрасте. Пути передачи вируса различны: воздушно-капельный, контактно-бытовой, трансфузионный, половой, трансплацентарный. После заражения ВЭБ репликация вируса в организме человека и формирование иммунного ответа могут протекать бессимптомно либо проявляться в виде незначительных признаков ОРВИ. Но при попадании большого количества инфекта и/или наличии в данный период значимого ослабления иммунной системы у пациента может развиться картина инфекционного мононуклеоза. Возможно несколько вариантов исхода острого инфекционного процесса:
- выздоровление (ДНК вируса можно выявить только при специальном исследовании в единичных В-лимфоцитах или эпителиальных клетках);
- бессимптомное вирусоносительство или латентная инфекция (вирус определяется в слюне или лимфоцитах при чувствительности метода ПЦР 10 копий в пробе);
- хроническая рецидивирующая инфекция: а) хроническая активная ВЭБ-инфекция по типу хронического инфекционного мононуклеоза; б) генерализованная форма хронической активной ВЭБ-инфекции с поражением ЦНС, миокарда, почек и др.; в) ВЭБ-ассоциированный гемофагоцитарный синдром; г) стертые или атипичные формы ВЭБ-инфекции: длительный субфебрилитет неясного генеза, клиника — рецидивирующие бактериальные, грибковые, часто микст-инфекции респираторного и желудочно-кишечного тракта, и другие проявления;
- развитие онкологического (лимфопролиферативного) процесса (множественные поликлональные , назофарингеальная карцинома, лейкоплакии языка и слизистых ротовой полости, и кишечника и др.);
- развитие аутоиммунного заболевания — , и др. (следует отметить, что две последние группы заболеваний могут развиваться через большой промежуток времени после инфицирования);
- согласно результатам исследований нашей лаборатории (и на основании ряда зарубежных публикаций), мы сделали вывод, что ВЭБ может играть важную роль в возникновении .
Ближайший и отдаленный прогноз для больного с острой инфекцией, вызванной ВЭБ, зависит от наличия и степени выраженности иммунной дисфункции, генетической предрасположенности к тем или иным ВЭБ-ассоциированным заболеваниям (см. выше), а также от наличия ряда внешних факторов (стрессы, инфекции, операционные вмешательства, неблагоприятное воздействие окружающей среды), повреждающих иммунную систему. Было обнаружено, что ВЭБ обладает большим набором генов, дающим ему возможность в определенной мере ускользать от иммунной системы человека. В частности, ВЭБ вырабатывает белки — аналоги ряда человеческих интерлейкинов и их рецепторов, изменяющих иммунный ответ . В период активного размножения вирус продуцирует ИЛ-10-подобный белок, который подавляет Т-клеточный иммунитет, функцию цитотоксических лимфоцитов, макрофагов, нарушает все этапы функционирования естественных киллеров (то есть важнейших систем противовирусной защиты). Другой вирусный белок (BI3) также может подавлять Т-клеточный иммунитет и блокировать активность клеток-киллеров (через подавление интерлейкина-12). Еще одно свойство ВЭБ, как и других герпес-вирусов, высокая мутабельность, позволяет ему на определенное время избегать воздействия специфических иммуноглобулинов (которые были наработаны к вирусу до его мутации) и клеток иммунной системы хозяина. Таким образом, размножение ВЭБ в организме человека может явиться причиной усугубления (возникновения) вторичного иммунодефицита.
Клинические формы хронической инфекции, вызванной вирусом Эпштейна—Барр
Хроническая активная ВЭБ-инфекция (ХА ВЭБИ) характеризуется длительным рецидивирующим течением и наличием клинических и лабораторных признаков вирусной активности . Пациентов беспокоят слабость, потливость, нередко — боли в мышцах и суставах, наличие кожных высыпаний, кашель, затрудненное носовое дыхание, дискомфорт в горле, боли, тяжесть в правом подреберье, прежде нехарактерные для данного больного головные боли, головокружение, эмоциональная лабильность, депрессивные расстройства, нарушение сна, снижение памяти, внимания, интеллекта. Часто наблюдаются субфебрильная температура, увеличение лимфоузлов, гепатоспленомегалия различной степени выраженности. Нередко эта симптоматика имеет волнообразный характер. Иногда больные описывают свое состояние как хронический грипп.
У значительной части больных с ХА ВЭБИ наблюдается присоединение других герпетических, бактериальных и грибковых инфекций ( , воспалительные заболевания верхних дыхательных путей и желудочно-кишечного тракта).
ХА ВЭБИ характеризуется лабораторными (косвенными) признаками вирусной активности, а именно относительным и абсолютным лимфомоноцитозом, наличием атипичных мононуклеаров, реже моноцитозом и лимфопенией, в ряде случаев анемией и тромбоцитозом. При исследовании иммунного статуса у больных ХА ВЭБИ наблюдаются изменение содержания и функции специфических цитотоксических лимфоцитов, естественных киллеров, нарушение специфического гуморального ответа (дисиммуноглобулинемия, длительное отсутствие наработки иммуноглобулина G (IgG) или так называемое отсутствие сероконверсии к позднему нуклеарному антигену вируса — EBNA, что отражает несостоятельность иммунологического контроля размножения вируса. Кроме того, по нашим данным, более чем у половины больных снижена способность к стимулированной продукции интерферона (ИФН), повышено содержание сывороточного ИФН, имеют место дисиммуноглобулинемия, нарушение авидности антител (их способности прочно связываться с антигеном), уменьшено содержания DR+лимфоцитов, нередко повышены показатели циркулирующих иммунных комплексов и антител к ДНК.
У лиц с выраженной иммунной недостаточностью возможно возникновение генерализованных форм ВЭБ-инфекции с поражением центральной и периферической нервной систем (развитие , энцефалита, мозжечковой атаксии, полирадикулоневритов), а также с поражением других внутренних органов (развитие , лимфоцитарного интерстициального пневмонита, тяжелых форм ). Генерализованные формы ВЭБ-инфекции нередко заканчиваются летальным исходом .
ВЭБ-ассоциированный гемофагоцитарный синдром характеризуется развитием анемии или панцитопении. Часто сочетается с ХА ВЭБИ, инфекционным мононуклеозом и лимфопролиферативными заболеваниями. В клинической картине преобладают интермиттирующая лихорадка, гепатоспленомегалия, лимфоаденопатия, панцитопения или выраженная анемия, печеночная дисфункция, коагулопатия. Гемофагоцитарный синдром, развивающийся на фоне инфекционного мононуклеоза, характеризуется высокой летальностью (до 35%). Вышеописанные изменения объясняют гиперпродукцией провоспалительных цитокинов (ФНО, ИЛ1 и ряда других) Т-клетками, инфицированными вирусом. Эти цитокины активируют систему фагоцитов (размножение, дифференцировку и функциональную активность) в костном мозге, периферической крови, печени, селезенке, лимфоузлах. Активированные моноциты и гистиоциты начинают поглощать клетки крови, что приводит к их разрушению. Более тонкие механизмы этих изменений находятся в стадии изучения.
Стертые варианты хронической ВЭБ-инфекции
По нашим данным, ХА ВЭБИ нередко протекает стерто или под масками других хронических заболеваний.
Можно выделить две наиболее часто встречающиеся формы латентной вялой ВЭБ-инфекции. В первом случае больных беспокоит длительный субфебрилитет неясного генеза, слабость, боли в периферических лимфоузлах, миалгии, артралгии. Характерна также волнообразность симптоматики . У другой категории больных помимо вышеописанных жалоб имеют место маркеры вторичного иммунодефицита в виде ранее нехарактерных для них частых инфекций дыхательных путей, кожи, желудочно-кишечного тракта, гениталий, которые на фоне терапии полностью не проходят или же быстро рецидивируют. Наиболее часто в анамнезе этих пациентов имеют место длительные стрессовые ситуации, чрезмерные психические и физические перегрузки, реже — увлечение голоданием, модными диетами и т. д. Нередко вышеописанное состояние развивалось после перенесенной ангины, ОРЗ, гриппоподобного заболевания. Характерными для этого варианта инфекции также являются устойчивость и длительность симптоматики — от шести месяцев до 10 и более лет. При повторных обследованиях обнаруживают ВЭБ в слюне и/или лимфоцитах периферической крови. Как правило, повторные углубленные обследования, проводимые у большинства этих пациентов, не позволяют обнаружить других причин длительного субфебрилитета и развития вторичного иммунодефицита.
Очень важен для постановки диагноза ХА ВЭБИ является и тот факт, что в случае устойчивого подавления вирусной репликации удается достичь длительной ремиссии у большинства пациентов. Диагностика ХА ВЭБИ затруднена из-за отсутствия специфических клинических маркеров заболевания. Определенный «вклад» в гиподиагностику вносит и недостаточная информированность практических врачей о данной патологии. Тем не менее, учитывая прогрессирующий характер ХА ВЭБИ, а также серьезность прогноза (риск развития лимфопролиферативных и аутоиммунных заболеваний, высокая летальность при развитии гемофагоцитарного синдрома), при подозрении на ХА ВЭБИ необходимо проводить соответствующее обследование. Наиболее характерный клинический симптомокомплекс при ХА ВЭБИ — это длительный субфебрилитет, слабость и снижение работоспособности, боли в горле, лимфаденопатия, гепатоспленомегалия, печеночная дисфункция, психические нарушения. Важным симптомом является отсутствие полного клинического эффекта от проведения общепринятой терапии астенического синдрома, общеукрепляющей терапии, а также от назначения антибактериальных препаратов.
При проведении дифференциальной диагностики ХА ВЭБИ в первую очередь следует исключить следующие заболевания:
- другие внутриклеточные, в том числе вирусные инфекции: ВИЧ, вирусные гепатиты, цитомегаловирусную инфекцию, токсоплазмоз и др.;
- ревматические заболевания, в том числе и ассоциированные с ВЭБ-инфекцией;
- онкологические заболевания.
Лабораторные исследования в диагностике ВЭБ-инфекции
- Клинический анализ крови: могут наблюдаться незначительный лейкоцитоз, лимфомоноцитоз с атипичными мононуклеарами, в ряде случаев гемолитическая анемия вследствие гемофагоцитарного синдрома или аутоиммунная анемия, возможно, тромбоцитопения или тромбоцитоз.
- Биохимический анализ крови: выявляются повышение уровня трансаминаз, ЛДГ и других ферментов, белков острой фазы, таких, как СРБ, фибриноген и др.
Как уже упоминалось выше, все перечисленные изменения не являются строго специфичными для ВЭБ-инфекции (их можно обнаружить и при других вирусных инфекциях).
- Иммунологическое обследование: желательно оценить основные показатели противовирусной защиты: состояние системы интерферона, уровень иммуноглобулинов основных классов, содержание цитотоксических лимфоцитов (CD8+), Т-хелперов (CD4+).
По нашим данным, в иммунном статусе при ВЭБ-инфекции встречаются два вида изменений: повышенная активность отдельных звеньев иммунной системы и/или дисбаланс и недостаточность других. Признаками напряженности противовирусного иммунитета могут быть повышенные уровни ИФН в сыворотке крови, IgА, IgМ, IgЕ, ЦИК, нередко — появление антител к ДНК, повышение содержания естественных киллеров (CD16+), Т-хелперов (CD4+) и/или цитотоксических лимфоцитов (CD8+). Система фагоцитов может быть активирована.
В свою очередь, иммунная дисфункция/недостаточность при этой инфекции проявляется снижением способности к стимулированной продукции ИФН альфа и/или гамма, дисиммуноглобулинемией (снижение содержания IgG, реже IgА, повышение содержания Ig М), снижением авидности антител (их способности прочно связываться с антигеном), снижением содержания DR+лимфоцитов, CD25+ лимфоцитов, то есть активированных Т-клеток, уменьшением числа и функциональной активности естественных киллеров (CD16+), Т-хелперов (CD4+), цитотоксических Т-лимфоцитов (CD8+), снижением функциональной активности фагоцитов и/или изменением (извращением) их реакции на стимулы, в том числе на иммунокорректоры.
- Серологические исследования: повышение титров антител (АТ) к антигенам (АГ) вируса является критерием наличия инфекционного процесса в настоящее время или свидетельством контакта с инфекцией в прошлом. При острой ВЭБ-инфекции, в зависимости от стадии болезни, в крови определяются разные классы АТ к АГ вируса, происходит смена «ранних» АТ на «поздние».
Специфические IgM-АТ появляются в острой фазе заболевания или в период обострения и через четыре-шесть недель, как правило, исчезают. IgG-АТ к ЕА (ранние) также появляются в острой фазе, являются маркерами активной репликации вируса и при выздоровлении снижаются за три-шесть месяцев. IgG-АТ к VCA (ранние) определяются в остром периоде с максимумом ко второй-четвертой неделе, затем их количество снижается, и пороговый уровень сохраняется длительное время. IgG-АТ к EBNA выявляются спустя два — четыре месяца после острой фазы, и их выработка сохраняется в течение всей жизни.
По нашим данным, при ХА ВЭБИ более чем у половины больных в крови определяются «ранние» IgG-АТ, в то время как специфические IgM-АТ определяются значительно реже, при этом содержание поздних IgG-АТ к EBNA колеблется в зависимости от стадии обострения и состояния иммунитета.
Надо отметить, что проведение серологического исследования в динамике помогает в оценке состояния гуморального ответа и эффективности противовирусной и иммунокорригирующей терапии.
- ДНК-диагностика ХА ВЭБИ. С помощью метода полимеразной цепной реакции (ПЦР) определение ДНК ВЭБ проводят в различных биологических материалах: слюне, сыворотке крови, лейкоцитах и лимфоцитах периферической крови. При необходимости проводят исследование в биоптатах печени, лимфоузлов, слизистой кишечника и т. д. Метод ПЦР-диагностики, характеризующийся высокой чувствительностью, нашел применение во многих областях, например в криминалистике: в частности, в тех случаях, когда необходимо идентифицировать минимальные следовые количества ДНК.
Использование данного метода в клинической практике для выявления того или иного внутриклеточного агента из-за слишком высокой его чувствительности нередко затруднено, так как нет возможности отличить здоровое носительство (минимальное количество инфекта) от проявлений инфекционного процесса с активным размножением вируса. Поэтому для клинических исследований используют ПЦР-методику с заданной, более низкой чувствительностью. Как показали наши исследования, применение методики с чувствительностью 10 копий в пробе (1000 ГЭ/мл в 1 мл образца) позволяет выявлять здоровых носителей ВЭБ, в то время как снижение чувствительности метода до 100 копий (10000 ГЭ/мл в 1 мл образца) дает возможность диагностировать лиц с клинико-иммунологическими признаками ХА ВЭБИ.
Мы наблюдали больных с наличием клинических и лабораторных данных (в том числе результатов серологических исследований), характерных для вирусной инфекции, у которых при первичном обследовании анализ на ДНК ВЭБ в слюне и клетках крови был отрицательным. Важно отметить, что в этих случаях нельзя исключить репликацию вируса в желудочно-кишечном тракте, костном мозге, коже, лимфоузлах и др. Только повторное обследование в динамике может подтвердить или исключить наличие или отсутствие ХА ВЭБИ.
Таким образом, для постановки диагноза ХА ВЭБИ помимо проведения общеклинического обследования необходимы исследование иммунного статуса (противовирусного иммунитета), ДНК, диагностика инфекции в различных материалах в динамике, серологические исследования (ИФА).
Лечение хронической Эпштейн—Барр-вирусной инфекции
В настоящее время общепринятых схем лечения ХА ВЭБИ не существует. Однако современные представления о влиянии ВЭБ на организм человека и данные об имеющемся риске развития серьезных, нередко фатальных заболеваний показывают необходимость проведения терапии и диспансерного наблюдения у больных, страдающих ХА ВЭБИ.
Данные литературы и опыт нашей работы позволяют дать патогенетически обоснованные рекомендации по терапии ХА ВЭБИ. В комплексном лечении данного заболевания используют следующие препараты:
- , в ряде случаев в сочетании с индукторами ИФН — (создание антивирусного состояния незараженных клеток, подавление размножения вируса, стимуляция естественных киллеров, фагоцитов);
- аномальные нуклеотиды (подавляют размножение вируса в клетке);
- иммуноглобулины для внутривенного введения (блокада «свободных» вирусов, находящихся в межклеточной жидкости, лимфе и крови);
- аналоги тимических гормонов (способствуют функционированию Т-звена, кроме того, стимулирует фагоцитоз);
- глюкокортикоиды и цитостатики (уменьшают репликацию вируса, воспалительную реакцию и повреждение органов).
Другие группы лекарств, как правило, играют вспомогательную роль.
До начала лечения желательно обследовать членов семьи больного на предмет выделения вирусов (со слюной) и возможности повторного инфицирования пациента, при необходимости подавление вирусной репликации проводят и у членов семьи.
- Объем терапии больных с хронической активной ВЭБ-инфекцией (ХА ВЭБИ) может быть различным, в зависимости от длительности заболевания, тяжести состояния и иммунных расстройств. Лечение начинают с назначения антиоксидантов и проведения детоксикации. В среднетяжелых и тяжелых случаях начальные этапы терапии желательно проводить в условиях стационара.
Препаратом выбора является интерферон-альфа, в среднетяжелых случаях назначаемый в виде монотерапии . Хорошо зарекомендовал себя (в том, что касается биологической активности и переносимости) отечественный рекомбинантный препарат реаферон, при этом стоимость его существенно ниже, чем у зарубежных аналогов. Используемые дозы ИФН-альфа различаются в зависимости от веса, возраста, переносимости препарата. Минимальные дозы — 2 млн. ЕД в сутки (по 1 млн. ЕД два раза в день внутримышечно), первую неделю ежедневно, затем три раза в неделю в течение трех-шести месяцев. Оптимальные дозы — 4-6 млн. ЕД (по 2—3 млн. ЕД два раза в день).
ИФН-альфа, как провоспалительный цитокин, может вызвать гриппоподобную симптоматику (лихорадка, головные боли, головокружение, миалгии, артралгии, вегетативные расстройства — изменение АД, ЧСС, реже диспептические явления).
Выраженность указанных симптомов зависит от дозы и индивидуальной переносимости препарата. Это преходящие симптомы (исчезают через 2—5 дней от начала лечения), и часть из них контролируется назначением нестероидных противовоспалительных средств. При лечении препаратами ИФН-альфа могут возникать обратимые тромбоцитопения, нейтропения, кожные реакции (зуд, сыпи разнообразного характера), редко — алопеция. Длительное применение ИФН-альфа в больших дозах может привести к иммунной дисфункции, клинически проявляющейся фурункулезом, другими гнойничковыми и вирусными поражениями кожи.
В среднетяжелых и тяжелых случаях, а также при неэффективности препаратов ИФН-альфа к лечению необходимо подключать аномальные нуклеодиты — валацикловир (валтрекс), ганцикловир (цимевен) или фамцикловир (фамвир).
Курс лечения аномальными нуклеотидами должен составлять не менее 14 дней, первые семь дней желательно внутривенное введение препарата.
В случаях тяжелого течения ХА ВЭБИ в комплексную терапию включают также препараты иммуноглобулинов для внутривенного введения в дозе 10—15 г. При необходимости (по результатам иммунологического обследования) — назначают иммунокорректоры с Т-активирующей способностью или замещающие тимические гормоны (тимоген, иммунофан, тактивин, и др.) в течение одного-двух месяцев с постепенной отменой или переходом на поддерживающие дозы (два раза в неделю).
Лечение ВЭБ-инфекции необходимо проводить под контролем клинического анализа крови (один раз в 7—14 дней), биохимического анализа (один раз в месяц, при необходимости чаще), иммунологического исследования — через один-два месяца.
- Лечение больных с генерализованной ВЭБ-инфекцией проводится в стационаре, совместно с невропатологом.
К противовирусной терапии препаратами ИФН-альфа и аномальными нуклеотидами в первую очередь подключают системные кортикостероиды в дозах: парентерально (в пересчете на преднизолон) 120-180 мг в сутки, или 1,5-3 мг/кг, возможно использование пульс-терапии метипредом 500 мг в/в капельно, или внутрь по 60-100 мг в сутки. Внутривенно вводят плазму и/или препараты иммуноглобулинов для внутривенного введения. При выраженной интоксикации показаны введение детоксицирующих растворов, плазмаферез, гемосорбция, назначение антиоксидантов. В тяжелых случаях применяют цитостатики: этопозид, циклоспорин (сандиммун или консупрен).
- Лечение больных ВЭБ-инфекцией, осложненной ГФС, необходимо проводить в стационаре. Если ведущим в клинической картине и прогнозе жизни является ГФС, терапию начинают с назначения больших доз кортикостероидов (блокада продукции провоспалительных цитокинов и фагоцитарной активности), в наиболее тяжелых случаях с цитостатиками (этопозид, циклоспорин) на фоне применения аномальных нуклеотидов .
- Лечение больных с латентной стертой ВЭБ-инфекцией может проводиться амбулаторно; терапия включает назначение интерферона-альфа (возможно чередование с препаратами индукторов ИФН). При недостаточной эффективности подключают аномальные нуклеотиды, препараты иммуноглобулинов для внутривенного введения; по результатам иммунологического обследования назначают иммунокорректоры (Т-активаторы). В случаях так называемого «носительства», или «бессимптомной латентной инфекции» с наличием специфического иммунного ответа на размножение вируса проводится наблюдение и лабораторный контроль (клинический анализ крови, биохимия, ПЦР-диагностика, иммунологическое обследование) через три-четыре месяца.
Лечение назначают при появлении клиники ВЭБ-инфекции или при формировании признаков ВИД.
Проведение комплексной терапии с включением указанных выше препаратов позволяет добиться ремиссии заболевания у части пациентов с генерализованной формой заболевания и при гемофагоцитарном синдроме. У больных со среднетяжелыми проявлениями ХА ВЭБИ и в случаях стертого течения заболевания эффективность терапии выше (70—80%) помимо клинического эффекта часто удается добиться подавления репликации вируса.
После подавления размножения вируса и получения клинического эффекта важно продлить ремиссию. Показано проведение санаторно-курортного лечения.
Больных следует информировать о важности соблюдения режима труда и отдыха, полноценного питания, ограничения/прекращения приема алкоголя; при наличии стрессовых ситуаций необходима помощь психотерапевта. Кроме того, при необходимости проводят поддерживающую иммунокорригирующую терапию.
Таким образом, лечение больных с хронической Эпштейн—Барр-вирусной инфекцией является комплексным, проводится под лабораторным контролем и включает применение препаратов интерферона-альфа, аномальных нуклеотидов, иммунокорректоров, заместительных иммунотропных препаратов, глюкокортикоидных гормонов, симптоматических средств.
Литература
- Гурцевич В. Э., Афанасьева Т. А. Гены латентной инфекции Эпштейна-Барр (ВЭБ) и их роль в возникновении неоплазий // Русский журнал <ВИЧ/СПИД и родственные проблемы>. 1998; Т. 2, № 1: 68-75.
- Дидковский Н. А., Малашенкова И. К., Тазулахова Э. Б. Индукторы интерферона — новый перспективный класс имммуномодуляторов // Аллергология. 1998. № 4. С. 26-32.
- Егорова О. Н., Балабанова Р. М., Чувиров Г. Н. Значение антител к герпетическим вирусам, определяемых у больных с ревматическими заболеваниями // Терапевтический архив. 1998. № 70(5). С. 41-45.
- Малашенкова И. К., Дидковский Н. А., Говорун В. М., Ильина Е. Н., Тазулахова Э. Б., Беликова М. М., Щепеткова И. Н. К вопросу о роли вируса Эпштейна-Барр в развитии синдрома хронической усталости и иммунной дисфункции.
- Christian Brander and Bruce D Walker Modulation of host immune responses by clinically relevant human DNA and RNA viruses //Current Opinion in Microbiology 2000, 3:379-386.
- Cruchley A. T., Williams D. M., Niedobitek G. Epstein-Barr virus: biology and disease // Oral Dis 1997 May; 3 Suppl 1: S153-S156.
- Glenda C. Faulkner, Andrew S. Krajewski and Dorothy H. CrawfordA The ins and outs of EBV infction // Trends in Microbiology. 2000, 8: 185-189.
- Jeffrey I. Cohen The biology of Epstein-Barr virus: lessons learned from the virus and the host // Current Opinion in Immunology. 1999. 11: 365-370.
- Kragsbjerg P. Chronic active mononucleosis // Scand. J. Infect. Dis. 1997. 29(5): 517-518.
- Kuwahara S., Kawada M., Uga S., Mori K. A case of cerebellar meningo-encephalitis caused by Epstein-Barr virus (EBV): usefulness of Gd-enhanced MRI for detection of the lesions // No To Shinkei. 2000. Jan. 52(1): 37-42.
- Lekstron-Himes J. A., Dale J. K., Kingma D. W. Periodic illness assotiated with Epstein-Barr virus infection // Clin. Infect. Dis. Jan. 22(1): 22-27.
- Okano M. Epstein-Barr virus infecion and its role in the expanding spectrum of human diseases // Acta Paediatr. 1998. Jan; 87(1): 11-18.
- Okuda T., Yumoto Y. Reactive hemophagocytic syndromeresponded to combination chemotherapy with steroid pulse therapy // Rinsho Ketsueki. 1997. Aug; 38(8): 657-62.
- Sakai Y., Ohga S., Tonegawa Y. Interferon-alpha therapy for chronic active Epstein-Barr virus infection // Leuk. Res. 1997. Oct; 21(10): 941-50.
- Yamashita S., Murakami C., Izumi Y. Severe chronic active Epstein- Barr virus infection accompanied by virus-associated hemophagocytic syndrome, cerebellar ataxia and encephalitis // Psychiatry Clin. Neurosci. 1998. Aug; 52(4): 449-52.
И. К. Малашенкова, кандидат медицинских наук
Н. А. Дидковский, доктор медицинских наук, профессор
Ж. Ш. Сарсания, кандидат медицинских наук
М. А. Жарова, Е. Н. Литвиненко, И. Н. Щепеткова, Л. И. Чистова, О. В. Пичужкина
НИИ физико-химической медицины МЗ РФ
Т. С. Гусева, О. В. Паршина
ГУНИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН, Москва
Клиническая иллюстрация случая хронической активной ВЭБ-инфекции с гемофагоцитарным синдромом
Больная И. Л., 33 лет, обратилась в лабораторию клинической иммунологии НИИ ФХМ 20.03.97 с жалобами на длительный субфебрилитет, выраженную слабость, потливость, боли в горле, сухой кашель, головные боли, одышку при движении, учащенное сердцебиение, нарушения сна, эмоциональную лабильность (повышенную раздражительность, обидчивость, плаксивость), забывчивость.
Из анамнеза: осенью 1996 года после тяжелой ангины (сопровождавшейся сильной лихорадкой, интоксикацией, лимфоаденопатией) возникли вышеуказанные жалобы, длительно сохранялись увеличение СОЭ, изменения лейкоцитарной формулы (моноцитоз, лейкоцитоз), была выявлена анемия. Амбулаторное лечение (антибиотикотерапия, сульфаниламиды, препараты железа и др.) оказалось неэффективным. Состояние прогрессивно ухудшалось.
При поступлении: t тела — 37,8°С, кожные покровы повышенной влажности, выраженная бледность кожи и слизистых. Лимфоузлы (подчелюстные, шейные, подмышечные) увеличены до 1-2 см, плотноэластической консистенции, болезненные, не спаяны с окружающими тканями. Зев гиперемирован, отечен, явления фарингита, миндалины увеличены, рыхлые, умеренно гиперемированы, язык обложен бело-серым налетом, гиперемирован. В легких дыхание с жестким оттенком, рассеянные сухие хрипы на вдохе. Границы сердца: левая увеличена на 0,5 см влево от среднеключичной линии, тоны сердца сохранены, короткий систолический шум над верхушкой, ритм неправильный, экстрасистолия (5—7 в мин), ЧСС — 112 в мин, АД — 115/70 мм рт ст. Живот вздут, умеренно болезненный при пальпации в правом подреберье и по ходу толстой кишки. По данным УЗИ органов брюшной полости, незначительное увеличение размеров печени и — в несколько большей степени — селезенки.
Из лабораторных анализов обращали на себя внимание нормохромная анемия со снижением Hb до 80 г/л с анизоцитозом, пойкилоцитозом, полихроматофилией эритроцитов; ретикулоцитоз, нормальное содержание сывороточного железа (18,6 мкм/л), отрицательная реакция Кумбса. Кроме того, наблюдались лейкоцитоз, тромбоцитоз и моноцитоз с большим количеством атипичных мононуклеаров, ускорение СОЭ. В биохимических анализах крови отмечались умеренное повышение трансаминаз, КФК. ЭКГ: ритм синусовый, неправильный, предсердная и желудочковая экстрасистолия, ЧСС до 120 в минуту. Электрическая ось сердца отклонена влево. Нарушение внутрижелудочковой проводимости. Снижение вольтажа в стандартных отведениях, диффузные изменения миокарда, в грудных отведениях наблюдались изменения, характерные для гипоксии миокарда. Также был существенно нарушен иммунный статус — повышено содержание иммуноглобулина М (IgМ) и снижено иммуноглобулинов А и G (IgА и IgG), наблюдалось преобладание продукции низкоавидных, то есть функционально неполноценных антител, дисфункция Т-звена иммунитета, повышение уровня сывороточного ИФН, снижение способности к продукции ИФН в ответ на многие стимулы.
В крови были повышены титры IgG-антител к ранним и поздним вирусным антигенам (VCA, EA EBV). При вирусологическом исследовании (в динамике) методом полимеразной цепной реакции (ПЦР) в лейкоцитах периферической крови была обнаружена ДНК ВЭБ.
В эту и последующие госпитализации проводились углубленное ревматологическое обследование и онкологический поиск, были исключены также другие соматические и инфекционные заболевания.
Больной были поставлены следующие диагнозы: хроническая активная ВЭБ-инфекция, умеренная гепатоспленомегалия, очаговый миокардит, соматогенно обусловленная персистирующая ; вирусассоциированный гемофагоцитарный синдром. Иммунодефицитное состояние; хронический фарингит, бронхит смешанной вирусно-бактериальной этиологии; , энтерит, дисбиоз кишечной флоры.
Несмотря на проведенную беседу, от введения глюкокортикоидов и препаратов интерферона-альфа больная категорически отказалась. Было проведено лечение, включающее противовирусную терапию (виролекс внутривенно в течение недели, с переходом на зовиракс 800 мг 5 раз в день per os), иммунокорригирующую терапию (тимоген по схеме, циклоферон 500 мг по схеме, иммунофан по схеме), заместительную терапию (октагам по 2,5 г два раза внутривенно капельно), детоксикационные мероприятия (инфузии гемодеза, энтеросорбция), антиоксидантную терапию (токоферрол, аскорбиновая кислота), использовали препараты-метаболики (эссенциале, рибоксин), назначалась витаминотерапия (поливитамины с микроэлементами).
После проведенного лечения у больной нормализовалась температура, уменьшились слабость, потливость, улучшились некоторые показатели иммунного статуса. Однако полностью подавить репликацию вируса не удалось (ВЭБ продолжал определяться в лейкоцитах). Клиническая ремиссия продолжалась недолго — через полтора месяца наступило повторное обострение. При исследовании помимо признаков активации вирусной инфекции, анемии, ускорения СОЭ были выявлены высокие титры антител к сальмонелле. Проводилось амбулаторное лечение основного и сопутствующего заболевания. Тяжелое обострение началось в январе 1998 года после острого бронхита и фарингита. По данным лабораторных исследований, в этот период отмечались утяжеление анемии (до 76 г/л) и нарастание количества атипичных мононуклеаров в крови. Отмечалось нарастание гепатоспленомегалии, в мазке из зева найдены Chlamidia Trachomatis, золотистый стафилококк, стрептококк, в моче — Ureaplasma Urealiticum, в крови обнаружено существенное повышение титров антител к EBV, CMV, вирусу простого герпеса 1-го типа (HSV 1). Таким образом, у больной увеличивалось число сопутствующих инфекций, что также свидетельствовало о нарастании недостаточности иммунитета. Проводилась терапия индукторами интерферона, заместительная терапия Т-активаторами, антиоксидантами, метаболиками, длительная детоксикация. Заметный клинический и лабораторный эффект был достигнут к июню 1998 года, пациентке рекомендовано продолжить метаболическую, антиоксидантную, иммунозаместительную терапию (тимоген и др.). При повторном исследовании осенью 1998 года в слюне и лимфоцитах ВЭБ не определялся, хотя сохранялись умеренная анемия и иммунная дисфункция.
Таким образом, у больной И., 33 лет, острая ВЭБ-инфекция приняла хроническое течение, осложнилась развитием гемофагоцитарного синдрома. Несмотря на то что удалось достигнуть клинической ремиссии, больная нуждается в динамическом наблюдении с целью как контроля репликации ВЭБ, так и своевременной диагностики лимфопролиферативных процессов (учитывая высокий риск их развития).
Обратите внимание!
- ВЭБ был впервые выделен из клеток лимфомы Беркетта 35 лет назад.
- Вирус Эпштейна—Барр относится к семейству герпес-вирусов.
- Сегодня примерно 80—90% населения инфицировано ВЭБ.
- Размножение ВЭБ в организме человека может явиться причиной усугубления (возникновения) вторичного иммунодефицита.
самые читаемые
- Показатели коагуляционного гемостаза в оценке эффективности лечения остеоартрита коленных суставов Онкология






